Dans les discours sur les solutions alternatives à la motorisation classique qui permettraient d’en résoudre les principaux inconvénients, on entend de plus en plus parler de la pile à combustible. Sans prétendre en être un spécialiste, il me semble quand même intéressant de rappeler quelques faits simples qui permettent de faire la part des choses sur le potentiel de cette technologie.
Pour commencer, la pile à combustible est une découverte vieille de plus d’un siècle : si cela était une solution miracle, il y a longtemps que nous le saurions ! Si le moteur à explosion a été industrialisé d’abord, c’est bien parce que la pile à combustible pose quelques problèmes qui ne sont pas si simples que cela à résoudre.
Mais examinons tout d’abord les avantages. La pile a combustible a incontestablement l’avantage d’émettre très peu de polluants locaux. Rappelons qu’il y a plusieurs manières de produire des polluants locaux avec une réaction de combustion (donc dans les moteurs ou les centrales thermiques) :
- soit par oxydation d’impuretés présentes dans le carburant. Par exemple si le carburant contient du soufre (présent à l’état naturel dans les hydrocarbures), sa combustion dégage du SO2, qui se transforme en acide sulfurique dans l’air par réaction avec l’eau,
- soit par combustion imparfaite. Le moteur agit alors comme une petite raffinerie : il chauffe des hydrocarbures sans les brûler et l’échappement rejette des composés volatils divers (composés aromatiques, méthane, etc) dont certains sont toxiques, ainsi que des composés de combustion imparfaite (CO notamment),
- soit à cause de la présence d’azote, que l’on peut difficilement éviter quand on utilise de l’air, puisqu’il en constitue 70% environ : à haute température, l’azote et l’oxygène de l’air réagissent et produisent des oxydes d’azote (les fameux NOx), dont certains sont directement toxiques, et d’autres, par réaction photochimique, conduisent à la formation d’ozone près du sol (l’ozone est une très bonne affaire dans la stratosphère, mais beaucoup moins près de nos poumons).
Or dans une pile à combustible on évite la combustion dans l’air à haute température, pour la remplacer par une réaction chimique en milieu liquide ou solide, comportant le plus souvent une catalyse (c’est-à-dire… l’emploi d’un catalyseur). Schématiquement une pile à combustible fait l’inverse d’un électrolyseur : dans une électrolyse on fait passer du courant dans une solution pour séparer des composés qui y sont dissous, alors que dans une pile on met des composés dans une solution – ou dans un électrolyte solide – et leur réaction chimique engendre du courant. De ce fait les polluants locaux, qui nécessitent une haute température dans l’air pour se produire (oxydes d’azote, la plupart des composés aromatiques, etc), ne sont plus émis par une pile à combustible.
Par ailleurs une pile à combustible produit de l’électricité, donc une voiture à pile à combustible est un cas particulier de voiture électrique, avec un avantage qui est que le moteur électrique dispose d’un rendement bien supérieur à celui d’un moteur thermique. Avec 1 kWh de carburant on finira par avoir 0,2 à 0,4 kWh d’énergie mécanique à la sortie du moteur (le reste est de la chaleur perdue pour faire avancer le véhicule), alors qu’avec 1 kWh d’électricité c’est plutôt 0,5 à 0,6 kWh d’énergie mécanique que l’on obtiendra à la sortie du moteur.
Si les piles ne se sont pas développées avec ces avantages, c’est qu’elles ont par ailleurs un gros inconvénient : elles fonctionnent toutes avec de l’hydrogène, composé qui n’existe pas à l’état natif à la surface de la terre. En d’autres termes, l’hydrogène n’existe nulle part sur notre planète sous une forme directement exploitable, comme cela est le cas pour les combustibles « fossiles ».
Pour obtenir ce précieux hydrogène, il faut dépenser de l’énergie, et plusieurs possibilités existent :
- on peut l’extraire d’hydrocarbures (pétrole, gaz, charbon liquéfié), par craquage à haute température dans des usines ; c’est du reste comme cela que l’essentiel de l’hydrogène est fait actuellement. . Lorsque cette opération est directement faite dans un véhicule, ce qui est aussi possible, on parle alors de « reformage ».
- on peut le produire par électrolyse de l’eau, mais alors… il aura fallu produire de l’électricité pour électrolyser de l’eau afin d’avoir de l’hydrogène qui lui-même produira de l’électricité dans une pile à combustible.
- on peut le produire par thermolyse de l’eau, c’est à dire que l’on décompose la molécule d’eau (composée d’oxygène et d’hydrogène) en la portant à très haute température. Il faut bien sûr aussi de l’énergie disponible sous une autre forme pour faire cela.
Pour les voitures
Pour les voitures, la seule solution envisagée pour une commercialisation dans un avenir pas trop lointain est l’extraction d’hydrocarbures, qui peut soit se faire dans une grosse usine (avec derrière stockage et transport de l’hydrogène), soit se faire directement dans le véhicule avec un « réformeur ». Dans les deux cas le processus consiste à prendre du gaz naturel ou un autre combustible contenant de l’hydrogène (notamment du méthanol, CH3OH), et à le chauffer très fort. La molécule se « casse » ; le carbone est oxydé en gaz carbonique (et généralement part dans l’air) et l’hydrogène est récupéré.
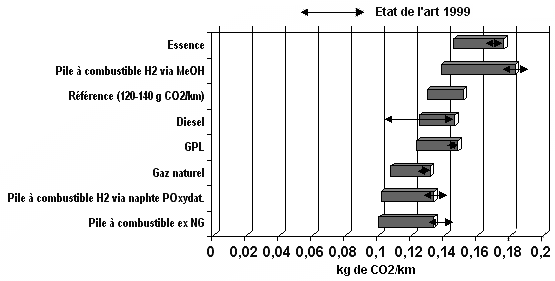
Comme d’une part l’énergie utilisée pour chauffer est généralement de l’énergie fossile, et d’autre part que le carbone libéré par la réaction concourt aussi à des émissions de CO2, il en résulte que cette production d’hydrogène n’est pas vraiment « propre ». A cause des émissions liées à la production, mais aussi au stockage et au transport, les émissions d’un bout à l’autre de la chaîne, que l’on appelle encore « du puits à la roue », c’est à dire qui tiennent compte de tout ce qui se passe entre le premier processus qui est nécessaire et le dernier qui l’est, les émissions par km de la pile à combustible sont sensiblement les mêmes (pour une même puissance de moteur, bien sûr !) que pour la combustion classique avec les technologies récentes (par ex. le HDI) (cf. ci-dessous), et supérieures à celles d’un moteur hybride HDI.
Cela ne veut pas dire que le moteur à explosion représente une solution parfaite (notre mobilité n’est pas durable, comme le dit un ingénieur général des Mines), mais substituer aux moteurs classiques des piles à combustible à hydrocarbures, toutes choses égales par ailleurs, ne permet que de gagner sur la pollution locale (NOx, CO, hydrocarbures aromatiques, particules, etc) et un peu sur le rendement, mais c’est tout.
Nous ne sommes donc pas dans les bons ordres de grandeur pour diviser par 4 les émissions de CO2 du transport (et le CO2 est un gaz à effet de serre, responsable du changement climatique). Nous y sommes d’autant moins que le parc automobile, actuellement aux alentours de 600 millions de véhicules, pourrait atteindre 2,5 milliards de véhicules en 2060 en évolution tendancielle (il suffit pour cela d’un modeste 2,5% de croissance annuelle du nombre de voitures en circulation). Cela étant, ce chiffre ne sera vraisemblablement jamais atteint : en « évolution tendancielle », notre civilisation aura probablement implosé bien avant.
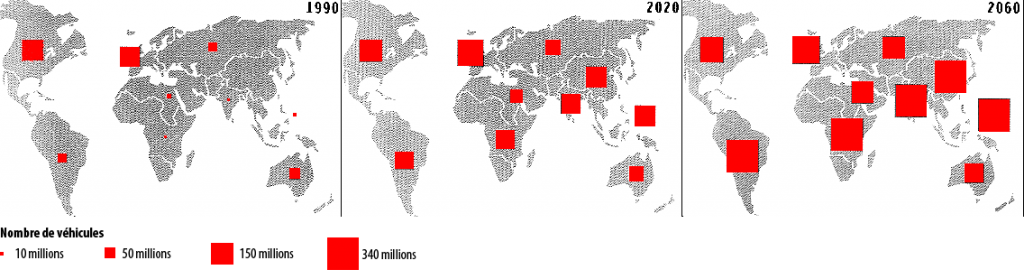
Projection de l’évolution du parc automobile mondial.
Source : Benjamin DESSUS, Atlas des énergies pour un monde vivable, Syros 1994.
Par ailleurs changer la motorisation des voitures à parc constant (or il croît !) et toutes choses égales par ailleurs (taille des voitures, puissance, etc) ne permet de résoudre ni les problèmes de congestion, ni ceux de dépense énergétique excessive. On peut consulter à cet effet quelques réflexions sur la voiture électrique, qui s’appliquent au moins partiellement au cas de la pile à combustible (le calcul sur les centrales supplémentaires donne l’ordre de grandeur de la dépense énergétique requise si l’on utilise autre chose que du pétrole).
La seule manière de rendre l’affaire non polluante y compris en ce qui concerne le CO2 est de faire fonctionner la pile à combustible avec de l’hydrogène lui-même obtenu sans recourir aux hydrocarbures. Les possibilités sont les suivantes :
- l’électrolyse ou la thermolyse de l’eau réalisée avec de l’énergie d’origine hydroélectrique, nucléaire, solaire, éolienne ou biomasse replantée,
- la production d’hydrogène par des bactéries génétiquement modifiées.
Dans ce cadre, outre le fait que seul le nucléaire est actuellement une source d’énergie du bon ordre de grandeur pour une production massive d’hydrogène (mais pas éternellement : la durée de vie du nucléaire actuel, à base de fission d’uranium, n’est guère que de un siècle et demi, alors qu’il ne représente que 5% de l’approvisionnement énergétique mondial, et la multiplication par 100 ou 1000 de cette quotité implique le recours à d’autres filières, dont la surgénération), un problème n’est pas simple à résoudre : le transport et le stockage de l’hydrogène, gaz non liquéfiable aux températures ambiantes, hautement inflammable (par contre beaucoup moins explosif que l’on ne l’imagine), et surtout très peu dense, ce qui rend son transport inéluctablement cher, pour de simples raisons physiques, qui ne sont pas près de disparaître.
La physique indique en effet que l’énergie nécessaire pour comprimer un gaz ne dépend pas du gaz, mais juste de la pression de départ et celle d’arrivée. Comprimer 1 m³ de méthane de 1 à 200 bars (parfois appelés « atmosphères » ; c’est la même chose !) ou comprimer 1 m³ de’hydrogène de 1 à 200 bars demande exactement la même quantité d’énergie. Comme faire passer un gaz dans un tuyau c’est essentiellement le comprimer à intervalles réguliers, il en résulte que la dépense d’énergie pour le transport et le stockage sont essentiellement proportionnels au volume de gaz. Mais brûler 1 m³ de méthane et 1 m³ d’hydrogène ne donnent pas la même énergie !
1 m³ de méthane (gaz naturel) libère une énergie de 9,89 kWh (35,6 MJ) en brûlant, alors qu’un m³ d’hydrogène ne libère que 3 kWh (environ 10 MJ). A cause de cette caractéristique, intangible, la dépense de transport sera donc au moins 3 fois plus importante, en proportion de l’énergie restituée, pour l’hydrogène que pour le méthane, et pour ce dernier la dépense en transport, ramenée à l’énergie transportée, est déjà bien supérieure à ce qu’elle est pour le pétrole.
Pour la production en pied d’immeuble
Les filières actuellement en phase commerciale de piles à combustible (à base d’hydrocarbures) offrent un rendement moins élevé que la cogénération, cette dernière permettant d’avoir chaleur et électricité pour une dépense énergétique à peu près équivalente à ce que l’on utilise pour de la chaleur seule. Il existe cependant des prototypes permettant d’envisager de la cogénération à base de piles à combustible (qui fonctionneraient à des températures très élevées, de plusieurs centaines de °C à 1.000 °C), mais la faisabilité à grande échelle est encore à l’étude.
Cela étant, comme pour la voiture, la pile à combustible ne permet pas de résoudre directement le problème des émissions de CO2 de manière significative si l’on l’alimente avec des hydrocarbures fossiles, et ce même lorsque la cogénération à base de piles sera au point. Cette remarque vaut aussi si les piles sont alimentées avec de l’hydrogène obtenu par craquage d’hydrocarbures. Les problèmes majeurs du changement climatique et de la pénurie inéluctable de combustibles fossiles en prolongation tendancielle (deux phénomènes qui marqueront probablement très fortement le siècle qui s’ouvre) restent donc posés tant que la production et la distribution d’hydrogène « en masse » ne sont pas possibles sans émissions de CO2.
Par contre l’avancée intéressante pourrait être d’utiliser une pile réversible en pied d’immeuble pour stocker une énergie électrique produite à un moment où nous n’en avons pas l’usage (nucléaire en heures creuses, solaire). Lorsqu’elle est alimentée, la pile se comporte alors comme un électrolyseur et produit de l’hydrogène que l’on stocke dans un réservoir (comme le gaz). Lorsqu’il n’y a pas de soleil et que l’on a besoin d’énergie, la pile fonctionne « normalement » en consommant l’hydrogène stocké.
Cela étant le rendement de l’affaire n’est que de 25% environ. Dit autrement, l’énergie électrique restituée ne constitue que 25% de l’énergie initialement utilisée pour électrolyser l’eau.
Dans tous les cas de figure
Enfin la pile à combustible nécessite actuellement pour sa fabrication des métaux rares, par exemple du platine, pour lequel un seul pays assure 70% de la production mondiale : l’Afrique du Sud. Cette production mondiale a totalisé 5.860.000 onces en 2001 (une once = 31,10 grammes), soit 180 tonnes environ. Aujourd’hui il faut environ 100 grammes de platine pour faire une pile à combustible de voiture, mais nous allons nous placer dans le cas de figure où seuls 30 grammes par pile seraient nécessaire, ce qui représente la possibilité ultime espérée avec ce métal. La production mondiale de platine (dont la moitié est déjà utilisée dans des pots catalytiques, dont il est vrai que la nécessité disparaît avec les piles) permettra alors de fabriquer de l’ordre de 5 millions de voitures par an.
Il faudrait donc 120 ans pour transformer le parc actuel (600 millions de voitures), et 600 ans pour y convertir un parc mondial passé à 3 milliards de véhicules, nombre qui sera atteint si le monde entier connait le même taux de motorisation que la France en l’an 2000.
Il est bien sûr possible (et même probable) qu’un autre catalyseur soit trouvé pour fabriquer une pile, mais le petit calcul ci-dessus montre simplement qu’entre un prototype de laboratoire et un objet disponible pour tout le monde, il peut y avoir des goulets d’étranglement qui ne sont pas si simples à franchir !