Comme chacun le sait (peut-être !), l’homme met désormais des quantités significatives de CO2 dans l’atmosphère, qui s’inscrivent bien sûr dans un cycle naturel du carbone bien plus vaste, qui comporte notamment des échanges entre atmosphère et océan.
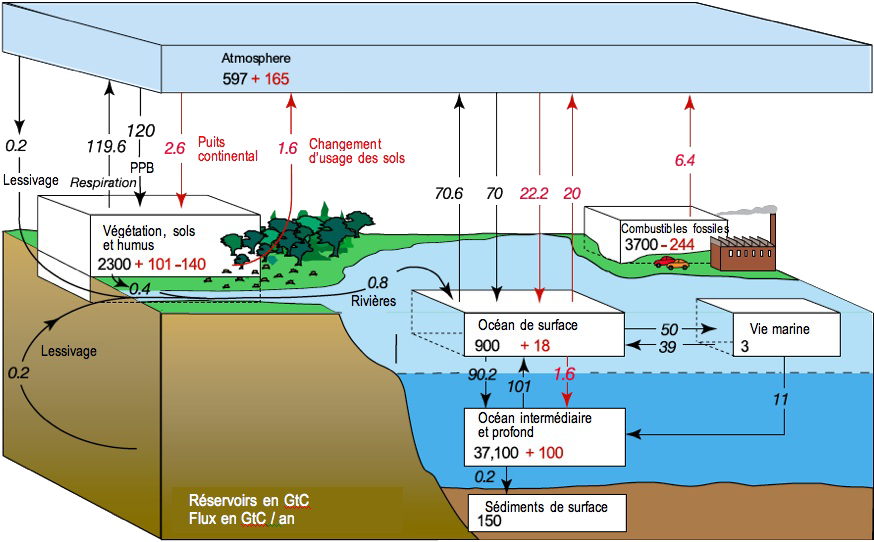
Représentation des stocks de carbone sur Terre susceptibles d’alimenter des échanges à l’échelle du siècle (ce diagramme ne représente donc pas le carbone contenu dans le calcaire, qui est de très loin le stock le plus important de la planète), et des flux annuels, le tout en milliards de tonnes de carbone (notées GtC).
Les flux en noir représentent les échanges « naturels », autrement dit ceux qui étaient les seuls à exister avant le début de l’ère industrielle, et les valeurs en noir pour les stocks représentent l’état (reconstitué) de 1750, avant le début des activités industrielles. Les flux en rouge représentent l’effet des activités humaines (flux renforcés, diminués, ou créés), pour la moyenne de la décennie 1990, et les valeurs en rouge pour les stocks représentent la variation de 1750 à 1994.
Ce diagramme signifie par exemple :
- que les sédiments de surface (la fraction des sédiments océaniques qui est au contact de l’eau) contiennent 150 milliards de tonnes de carbone, montant inchangé depuis le début des activités industrielles,
- que l’océan intermédiaire et profond contenait 37.100 milliards de tonnes de carbone en 1750, montant qui a augmenté de 100 milliards de tonnes de carbone depuis le début des activités industrielles,
- que les écosystèmes terrestres contenaient 2.300 milliards de tonnes de carbone en 1750 (dans les plantes, les sols et l’humus), montant qui a augmenté de 101 milliards de tonnes de carbone depuis le début des activités industrielles au titre de l’accroissement de la productivité des plantes (plus de CO2 et plus chaud = croissance plus rapide) mais qui a baissé de 140 milliards de tonnes de carbone sur la même durée à cause de la déforestation et éventuellement du déstockage d’une partie du carbone du sol,
- que l’atmosphère contenait 597 milliards de tonnes de carbone en 1750, montant qui a augmenté de 165 milliards de tonnes de carbone depuis le début des activités industrielles suite aux émissions de CO2,
- que l’influence des activités humaines a conduit l’océan de surface à émettre 20 milliards de tonnes de carbone par an en plus de ce qu’il émettait en 1750 (flèche rouge vers le haut), essentiellement à cause de l’augmentation de sa température de surface (une eau océanique qui se réchauffe « dégaze » une partie du CO2 dissous qu’elle contient), mais aussi à absorber 22,2 milliards de tonnes de carbone par an en plus de ce qu’il absorbait en 1750, en réponse à l’augmentation de la concentration atmosphérique en CO2 (plus de CO2 dans l’air « pousse » plus fort le CO2 à se dissoudre dans l’eau de l’océan),
- que le stock de combustibles fossiles (tout agrégé : pétroles, gaz, charbons) valait environ 3700 milliards de tonnes de carbone en 1750 – avant que l’on ne commence à piocher dedans – et que fin 1994 nous avions « déstocké » (en fait brûlé, donc avec transfert à l’atmosphère) environ 244 milliards de tonnes de carbone (pour info entre 1994 et 2005 cette valeur a augment de 30%).
NB : les émissions de CO2 d’origine fossile, qui sont à 6,5 milliards de tonnes de carbone – environ 24 milliards de tonnes de CO2 – par an sur ce diagramme (soit la moyenne de la décennie 1990) sont désormais de presque 8 milliards de tonnes de carbone par an.
Source : GIEC, 4è rapport d’évaluation, 2007.
Les échanges de CO2 entre l’atmosphère et l’océan de surface (environ 90 milliards de tonnes de carbone par an dans le schéma ci-dessus) ne doivent pas grand chose à la vie marine. En fait, en première approximation, ils ne lui doivent même rien du tout : si nous supprimons tous les poissons et toutes les baleines, cela aura assurément des inconvénients, mais pas celui de ralentir les échanges de CO2 entre l’atmosphère et l’océan de surface ! Ces échanges sont par contre très liés à l’existence d’une circulation océanique globale, qui refroidit des masses d’eau à certains endroits de la planète (par exemple l’eau du Gulf Stream qui remonte vers le Pôle Nord), et réchauffe l’eau de surface à d’autres endroits (par exemple l’eau du courant du Labrador qui s’éloigne du Pole Nord).
En effet, il se trouve que le CO2 se dissout mieux dans l’eau froide que dans l’eau chaude (à la question « pourquoi », la meilleure réponse sera que c’est comme ça !), et du coup là où l’eau se refroidit, du CO2 passe de l’air dans l’eau, alors que là où l’eau se réchauffe, du CO2 passe de l’eau dans l’air. Cette caractéristique explique du reste pourquoi, dans un climat qui se réchauffe, le puits océanique aura tendance à s’affaiblir : l’eau qui se refroidit deviendra néanmoins un peu moins froide qu’avant, ce qui diminuera – en moyenne – l’absorption de CO2 par l’eau qui se refroidit, alors que les émissions de CO2 de la partie de l’océan qui se réchauffe, et qui se réchauffera encore plus (en moyenne aussi), auront tendance à augmenter.
Mais une fois « absorbé » par l’eau de mer, l’essentiel du CO2 ne va pas rester sous cette forme, pas plus que le CO2 « absorbé » par les écosystèmes continentaux ne reste sous cette forme, du reste. Une fois dissous dans l’eau de mer, une partie du CO2 réagit avec l’eau pour former des ions hydrogénocarbonate (que l’on appelait autrefois bicarbonate), de formule HCO3-, puis des ions carbonate, de formule CO3–.
Plus exactement, les réactions qui s’enchaînent sont les suivantes :
CO2 + H2O → H2CO3 → HCO3- + H+ → CO3– + 2H+
En fait, comme toute réaction chimique, celles-ci peuvent se produire dans un sens ou dans l’autre (cela dépend des conditions initiales, et pour des conditions données il y a bien sûr un sens qui est privilégié). On doit donc plutôt écrire :
CO2 + H2O ↔ H2CO3 ↔ HCO3- + H+ ↔ CO3– + 2H+
Et de vieux souvenirs de chimie permettront peut être au lecteur de se rappeler qu’un composé qui « produit » des ions H+ s’appelle…. un acide. Ce que dit la réaction ci-dessus, c’est donc que la dissolution du CO2 dans l’eau de mer acidifie cette dernière. C’est du reste à cause de cette propriété que, en des temps anciens, le CO2 s’appelait « acide carbonique » (c’est par exemple le terme employé par Arrhenius dans son article prémonitoire sur le changement climatique qui allait découler de la civilisation industrielle).
Ce que ne dit pas l’équilibre chimique ci-dessus, par contre, c’est que si il y a plus de CO2 dans l’air, il va y en avoir plus dans l’eau. Il ne s’agit plus de chimie ici, mais de thermodynamique (aie aie aie ! voici des noms de plus en plus barbares !). Dit autrement, si l’air contient plus de CO2, ce dernier « passe » en plus grande quantité dans l’eau qui est à son contact, et une fois dans cette dernière il modifie l’acidité en formant des ions H+. De telles modifications d’acidité de l’océan ont donc eu lieu dans le passé, au gré des variations naturelles de la concentration atmosphérique en CO2.
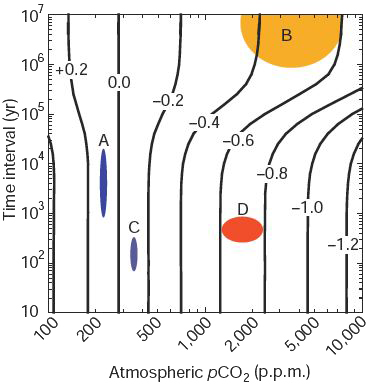
Variations comparées de pH de l’océan de surface au cours des ères passés (le code couleur figure sur l’échelle du bas). Les courbes noires « verticales » donnent la plage d’évolution du pH de l’océan de surface en fonction de la vitesse d’augmentation de la concentration de CO2 dans l’air. Ainsi une élévation de CO2 de 2000 ppm se produisant en quelques millions d’années donne une diminution de pH limitée à 0,5, mais la même se produisant en quelques siècles acidifie l’océan de 0,8 unité de pH.
A – variation d’acidité de l’océan de surface entre les ères glaciaires et les ères interglaciaires (comme maintenant) : pH±0,1 en quelques milliers d’années
B – variation d’acidité de l’océan de surface au cours des 300 millions d’années : pH ±0,5
C – variation d’acidité de l’océan de surface au cours du dernier siècle sous l’effet des émissions de CO2 déjà effectuées : pH±0,1
D – variation possible du pH sous l’effet des émissions futures, en version « haute » : avec un gain de 1000 à 2000 ppm de CO2 en quelques siècles, l’océan s’acidifierait de 0,5 unités de pH. Ce serait sans précédent en termes de diminution de pH depuis des millions (dizaines de millions ? centaines de millions ?) d’années, parce que la vitesse d’augmentation de CO2 dans l’air serait inédite. Une telle évolution – en quelques siècles – n’est pas impossible si les puits continentaux de CO2 se transforment en source.
Source Caldeira & Wickett, Nature, 2003
De tout ce qui précède, on peut donc déduire que le fait d’augmenter la concentration en CO2 dans l’air, ce que l’homme est incontestablement en train de faire, va non seulement avoir pour résultat de changer le climat, mais aussi d’acidifier un peu l’océan. En particulier, même avec des émissions que l’on considère fréquemment comme « modérées » (une concentration en CO2 atteignant 550 parties par million en 2100), mais qui de fait ne le sont pas tant que cela, l’océan perdra 0,2 à 0,3 unités de pH en 2100 par rapport à maintenant.
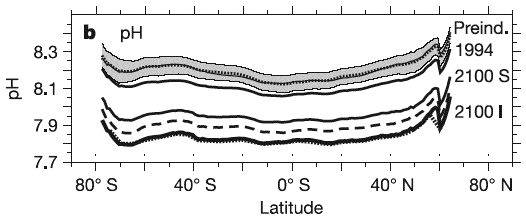
pH de l’océan de surface (axe vertical) en fonction de la latitude (axe du bas ; 90°S = pôle sud, et 90°N = pôle nord, on s’en doute !) et de la concentration atmosphérique en CO2.
La zone grisée du haut – centrée sur une courbe en pointillés – donne la plage de pH pour l’époque préindustrielle, évaluée par modélisation ; la courbe noire du haut avec l’indication 1994 donne le pH mesuré en 1994, et les courbes du bas donnent le pH en 2100 selon que le scénario d’émission est élevé (I pour Is92a, 800 ppmv de CO2 en 2100) ou plus modéré (S pour S650, environ 550 ppmv de CO2 en 2100 puis stabilisation à 650).
Source Orr et al., Nature, septembre 2005
Et c’est grave, docteur ? Peut-être un peu, car l’acidification de l’eau aura des répercussions sur la vie marine, indépendamment de tout changement de climat. En effet, une partie significative des organismes marins a besoin de synthétiser du calcaire, soit pour faire une coquille (huîtres, moules, bigorneaux, homards, et plus généralement tous les mollusques à coquille et tous les crustacés), soit un squelette (coraux, plancton). Or la réaction chimique de formation du calcaire est plus ou moins aisée en fonction de l’acidité de l’eau : plus l’eau est acide, et plus il est difficile à l’organisme de « fabriquer » du calcaire.
Peut-on revenir à quelques équations simples de chimie ? Alors voici ce qui se passe normalement chez « Mr. corail » ou « Mme huître » quand il ou elle construit son squelette :
Ca++ + CO3– → CaCO3
En d’autres termes, ces organismes utilisent des ions calcium dissous dans l’eau de mer et les font réagir avec les ions carbonate pour « produire » du carbonate de calcium, qui n’est que le nom barbare du … calcaire.
Nous avons vu plus haut que le CO2 qui se dissout dans l’eau engendre des « successeurs » que sont l’hydrogénocarbonate (HCO3-) et le carbonate (CO3–), et qu’il s’établit une concentration d’équilibre entre les deux qui dépend des conditions du moment. Par exemple, sous les tropiques (là où sont les coraux), l’hydrogénocarbonate représente 85% du carbone dissous, et le carbonate 15%. Si l’acidité augmente, les proportions respectives de carbonate et hydrogénocarbonate vont changer, et plus précisément les carbonates diminuent (graphique ci-dessous).
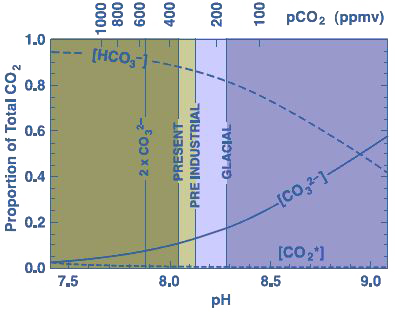
Proportions respectives de carbonates, d’hydrogénocarbonates, et de CO2 dissous en fonction de l’acidité de l’eau de mer. Le pH actuel de l’eau de mer est de l’ordre de 8 (donc l’eau de mer est légèrement basique).
Si le CO2 augmente, la proportion d’ions carbonate dans l’eau diminue, et donc la formation du calcaire devient plus difficile.
Source : Coral reefs & Global climate change, Pew Center on climate change, 2004
Or ce sont uniquement les carbonates qui sont utilisés par les organismes marins qui ont besoin de se construire une coquille ou un squelette, et l’on peut assez raisonnablement penser qu’avec une proportion de carbonates en baisse, cette partie de la vie marine va connaître des temps plus difficiles. Ainsi, les expériences de laboratoire montrent qu’avec un doublement du CO2 dans l’air par rapport à maintenant, la calcification (c’est-à-dire la fabrication du calcaire par les organismes qui en font) ralentit de 10 à 40%, aussi bien pour le corail que pour les algues à coquille du phytoplancton.
Les simulations effectuées avec des modèles couplant océan et cycle du carbone montrent quant à elles que la concentration en ions carbonate pourrait être divisée par deux aux hautes latitudes (passant de 100 à 50 micromoles par litre d’eau de mer) d’ici 2100 (graphique ci-dessous).
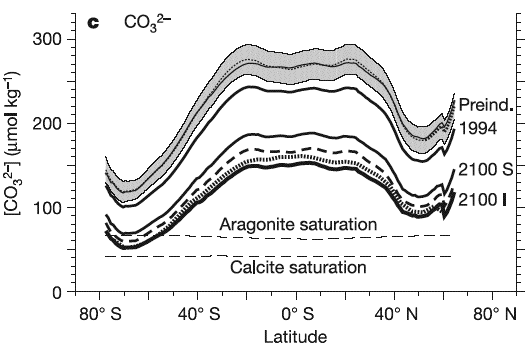
Concentration en ion carbonate (CO3–) en fonction de la latitude selon l’époque. La courbe indicée 1994 indique le profil de concentration en carbonate mesuré en 1994 ; la zone grisée donne la fourchette simulée pour l’ère préindustrielle, et enfin les concentrations simulées pour 2100 avec les scénarios S et I correspondent aux courbes indicées avec ces lettres.
La courbe en pointillés gras le résultat un peu différent du modèle IPSL pour le scénario IS92a.
Les courbes tiretées horizontales marquées « aragonite saturation » et « calcite saturation » donnent les concentrations minimales en ions carbonate qui sont nécessaires pour synthétiser de l’aragonite (une forme de calcaire) et de la calcite (une autre forme). Clairement, même avec un scénario « modéré » (S650), la concentration en carbonates dans les hautes latitudes deviendrait insuffisante en 2100 pour permettre la survie des micro-organismes ayant besoin de synthétiser une coquille ou un squelette en aragonite.
Source Orr et al., Nature, Septembre 2005
Dans tous les cas de figure, la variation du pH qui est potentiellement attendue sera d’une brutalité considérable au regard de son évolution naturelle sur les 25 derniers millions d’années.

Evolution possible du pH océanique à l’avenir, et comparaison avec les valeurs passées sur les 25 derniers millions d’années.
Source Pearson et al., Atmospheric carbon dioxide concentrations over the past 60 million years. Nature, 2000, cité in Turley et al. DEFRA 2006
Pour le moment l’acidité de l’océan ne pose pas encore de problème à très grande échelle, mais l’expérience en cours est inédite, non terminée, et l’océan que connaîtront nos successeurs pourrait être (sera ?) assez différent de celui que nous connaissons…. et l’océan n’a pas besoin de cela !

Biomasse dans l ‘Atlantique Nord de 1900 à 2000, pour les poissons de niveau trophique > 3,5 (c’est-à-dire qui arrivent au moins en 3è ou 4è position dans la chaîne alimentaire), reconstituée à partir de 23 modèles de réseaux trophiques.
Même sans changement climatique ou acidification de l’océan, la pression humaine s’est déjà exercée!
Source : La Recherche, juillet 2002